KAIST, 원자 한 개로 분자 접는 원리 찾아…AI 신약 개발 가속화
 하이커뮤니티매니져
0
12
13:56
하이커뮤니티매니져
0
12
13:56

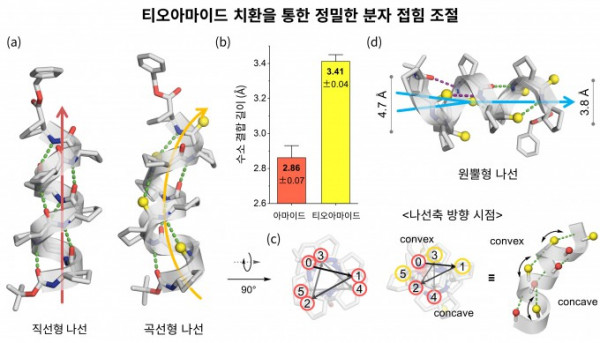

KAIST 연구팀이 산소를 황으로 바꿔 분자 접힘을 제어하는 기술로 AI 신약 개발의 기반을 마련했다. 이희승 석좌교수(왼쪽부터), 홍정우 박사, 김재욱 박사. KAIST 제공
분자를 이루는 원자 한 개만 바꿔도 약물의 형태를 완전히 바꿀 수 있는 기술이 개발됐다. 국내 연구진이 찾아낸 이 '분자 접는 법'은 인공지능(AI)을 활용한 맞춤형 신약 개발에 도움을 줄 전망이다.
KAIST는 이노코어 AI-CRED 혁신 신약 연구단이 단백질의 기본 구성 요소인 펩타이드에서 산소 원자 하나를 황 원자로 치환하는 ‘티오아마이드 변환’을 통해 분자의 접힘 방식을 정밀 제어하는 새로운 원리를 규명했다고 16일 밝혔다. 연구 결과는 국제학술지 ‘미국화학회지(JACS)’에 10월 29일 표지 논문으로 실렸다.
약이 우리 몸에서 제대로 작용하려면 마치 열쇠가 자물쇠에 딱 맞아야 하듯 약물 분자가 체내 단백질의 특정 부위에 정확히 들어맞아야 한다. 문제는 분자가 어떤 입체 구조로 '접히느냐'에 따라 이 맞춤이 결정된다는 점이다.
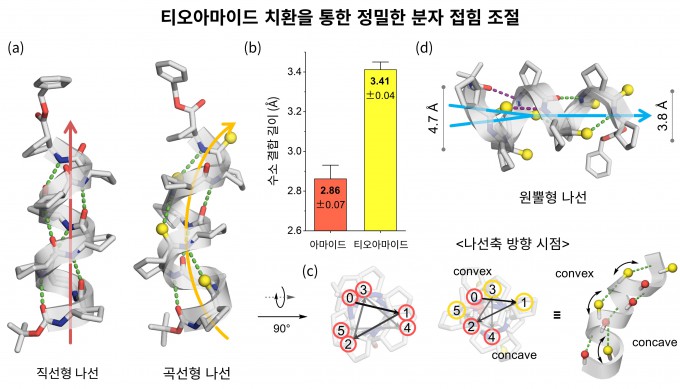
연구팀이 펩타이드 분자에서 산소를 황으로 바꾸자 분자 내부 결합 거리가 달라지면서 직선형 구조가 곡선형·원뿔형으로 변했다. (a) 직선형과 곡선형 나선 비교 (b) 수소결합 거리 변화 (c) 곡선 나선의 비대칭 단면 (d) 원뿔형 나선 KAIST 제공
연구팀은 펩타이드를 구성하는 산소 원자(O)를 황 원자(S)로 바꾸는 간단한 방법으로 이 문제를 해결했다. 개발한 방법으로수소결합의 길이와 방향을 바꿔 기존에 없던 곡선형·원뿔형 나선 구조를 유도하고 대칭성이 높은 ‘매크로사이클(macrocycle)’ 형태까지 만들어낼 수 있다는 사실도 확인했다. 원자 하나의 변화가 분자의 전체 입체 구조를 ‘프로그래밍하듯’ 설계할 수 있게 한 셈이다.
기술의 장점은 황을 도입한 펩타이드가 물에 훨씬 잘 녹아 실험실에서 다루기 쉬워졌다는 점이다. 실제로 연구팀은 세계에서 가장 긴 'β-펩타이드'를 용액에서 합성하는 데 성공했다.
게다가 필요하면 황을 다시 산소로 되돌릴 수도 있다. 은 이온을 이용한 간단한 화학반응으로 분자 구조를 자유자재로 편집할 수 있다는 뜻이다.
티오아마이드 변환으로 만들어진 곡선형·원뿔형 나선 구조와 고대칭 매크로사이클은 기존 펩타이드에서는 구현하기 어려웠던 새로운 접힘 패턴이다. 이처럼 다채로운 구조 변이는 AI가 학습할 수 있는 고정밀 데이터를 크게 확장시킨다.
이번 연구가 더욱 주목받는 이유는 AI 신약 개발에 필수적인 데이터를 제공하기 때문이다. 지금까지는 AI가 학습할 만한 정밀한 분자 구조 데이터가 부족했다. 하지만 이번에 개발된 기술로 만든 다양한 분자 구조 정보를 AI에 입력하면 AI는 '어떤 구조가 어떤 효과를 내는지' 스스로 패턴을 찾아낼 수 있다. 이를 통해 AI는 신약 후보 물질을 훨씬 빠르고 정확하게 예측할 수 있게 된다.
이희승 KAIST 석좌교수는 “간단한 화학적 변화를 통해 분자의 형태를 정밀하게 제어할 수 있음을 보여준 연구”라며 “AI가 학습하기에 최적화된 구조 데이터를 제공함으로써 향후 AI 기반 혁신 신약 설계의 출발점이 될 것”이라고 밝혔다.
연구팀은 이 기술이 단백질-펩타이드 상호작용 조절제, 자기조립 나노구조체, 차세대 바이오소재 등 다양한 분야로 확장될 수 있을 것으로 전망했다.
https://m.dongascience.com/news.php?idx=75112
토토하이, 토토하이먹튀신고, 토토힌먹튀사이트, 토토하이먹튀검증사이트, 토토하이먹튀없는사이트, 토토먹튀, 먹튀토토, 토토하이먹튀예방, 토토하이먹튀제보, 토토하이먹튀확인, 토토하이먹튀이력조회, 먹튀피해, 토토하이먹튀검증업체, 토토하이먹튀사이트검증, 토토하이먹튀공유, 토토하이먹튀사이트목록, 토토하이먹튀리스트, 토토하이안전공원, 토토하이안전놀이터, 토토하이안전사이트, 토토하이검증사이트





 리버풀
리버풀
 아스널
아스널
 애스턴 빌라
애스턴 빌라
 토트넘
토트넘
 맨시티
맨시티
 맨유
맨유
 웨스트햄
웨스트햄
 뉴캐슬
뉴캐슬
 브라이튼
브라이튼
 본머스
본머스
 첼시
첼시
 울버햄튼
울버햄튼
 풀럼
풀럼
 브렌트포드
브렌트포드
 크리스탈 팰리스
크리스탈 팰리스
 노팅엄 포레스트
노팅엄 포레스트
 에버턴
에버턴
 루턴
루턴
 번리
번리
 셰필드
셰필드
 프리미엄카지노총판
프리미엄카지노총판 실버스틸
실버스틸 킹덤sms
킹덤sms 리딕션미
리딕션미